DAS PROBLEM MIT DEM SAUERSTOFF
Mittlerweile dürfte es sich auch beim hinterwäldlerischsten Tauchclub herumgesprochen haben, dass es außer Pressluft auch andere Atemgase gibt und insbesondere sauerstoffangereicherte Luft - sprich NITROX - auch bei uns in Deutschland auf dem Vormarsch ist. Wer noch nie was davon gehört hat, sollte schnell mal ein Seminar über Nitrox-Tauchen besuchen.
Wir alle kennen Sauerstoff, Symbol O, als farb-, geruch- und geschmackloses Gas, mit schwach magnetischen Eigenschaften. Das Element steht in der sechsten Hauptgruppe des Periodensystems und zählt damit zu den Chalkogenen (vergl. Chemiebuch, 6. Klasse).
Sauerstoff ist das häufigste Element auf der Erde. Er kommt hauptsächlich in der Luft, im Wasser und in der Erdkruste vor. Sauerstoff wurde 1771/72 von dem schwedischen Chemiker Carl Wilhelm Scheele entdeckt, und 1777 näher beschrieben. Unabhängig von ihm entdeckte auch der englische Chemiker Joseph Priestley 1774 den Sauerstoff. Dass es sich bei dem neuen Stoff um ein Element handelte, konnte erst der französische Chemiker Antoine Laurent Lavoisier in seinen klassischen Verbrennungsversuchen beweisen.
Eigenschaften und Vorkommen
Gasförmiger Sauerstoff kann zu einer blassblauen Flüssigkeit kondensiert werden (bei -182,96 °C). In diesem Zustand zeigt er starke magnetische Eigenschaften. Ebenfalls blassblau ist der feste Sauerstoff. Er lässt sich durch Kompression des flüssigen Elements herstellen. Sauerstoff hat die Atommasse 15,9994. Unter Atmosphärendruck siedet Sauerstoff bei -182,96 °C und schmilzt bei -218,4 °C. In der Natur kommt Sauerstoff in drei Isotopenformen vor: 16O (zu etwa 99,76 Prozent), 17O (zu etwa 0,04 Prozent) und 18O (zu etwa 0,2 Prozent).
Sauerstoff ist zu 21 Volumenprozent in der Atmosphäre enthalten. Ungefähr 85,8 Gewichtsprozent des Meerwassers besteht aus Sauerstoff (reines Wasser enthält 88,8 Gewichtsprozent Sauerstoff). Außerdem ist Sauerstoff ein Bestandteil fast aller Gesteine und Mineralien - meist in Form von Oxiden. Er macht etwa 46,7 Gewichtsprozent der Erdkruste aus. Der menschliche Körper enthält rund 60 Prozent Sauerstoff (vielleicht sind manche deshalb so explosiv!). Sauerstoff ist der lebenswichtige Anteil unseres Atemgases Luft. In den roten Blutkörperchen wird er chemisch an das Hämoglobin gebunden und mit dem Blutstrom durch den Körper transportiert. In unserem Stoffwechsel wird er zur Energiegewinnung benötigt. Als Abfallprodukt entsteht dabei u.a. Kohlendioxid.
Es gibt drei Molekülstrukturen, in denen der Sauerstoff auftreten kann. Gewöhnlicher Sauerstoff besteht aus zweiatomigen Molekülen mit der chemischen Formel O2. Im Ozon liegen dreiatomige Moleküle vor: O3.
Die wichtigsten industriellen Produktionsverfahren sind die Elektrolyse von Wasser und die fraktionierte Destillation von flüssiger Luft. Das geht so ähnlich wie das Schnapsbrennen. Dabei wird zunächst Luft zu einer Flüssigkeit kondensiert, die man anschließend verdampfen lässt. Der in der Luft enthaltene Stickstoff ist leichter flüchtig als der Sauerstoff. Der Stickstoff verdampft daher zuerst, wobei flüssiger Sauerstoff zurückbleibt, ein hellblauer Klarer, der absolut trinkungeeignet ist. Sauerstoff wird üblicherweise unter hohem Druck in Stahlflaschen aufbewahrt. In solchen kann er auch in einem Sauerstoffwerk eingekauft werden, z.B. in einer 50 Liter-Vorratsflasche mit 200 bar Fülldruck.
Da Sauerstoff die Verbrennung fördert, müssen beim Hantieren mit Sauerstoff besondere Sicherheitsbestimmungen eingehalten werden. Diese alle aufzulisten ist mir hier zu viel Arbeit. Eins soll jedoch unbedingt vermittelt werden: Vermeidet Sauerstoffkontakt mit Ölen, Fetten oder anderen nicht sauerstoffgeeigneten Schmierstoffen. Heftigste Explosionen könnten sonst die Folge sein.
Das bedeutet auch, Tauchflaschen, die mit reinem Sauerstoff oder sauerstoffangereicherten Gasgemischen gefüllt werden sollen, müssen entweder speziell dafür geeignet sein (dafür gibt's in Europa schließlich Normen) oder sorgfältigst inklusive der Ventile entfettet werden. Ferner müssen sauerstofftaugliche O-Ringe verwendet werden.
Soweit einige allgemeinen Informationen zum Sauerstoff. Und nun zum eigentlichen Problem:
Sauerstoffvergiftung
Klar ist, mit zu wenig Sauerstoff gibt's nicht viel zu Atmen - aber zum Thema Hypoxie vielleicht ein andermal. Mit zuviel Sauerstoff haben wir aber auch nichts zu lachen. Zu hohe Sauerstoffpartialdrucke sind nämlich für den Organismus giftig. Hierbei spielt der Zeitfaktor zwar eine wichtige Rolle, es gibt jedoch erhebliche interindividuelle (.d.h. zwischen den verschiedenen Individuen...) und intraindividuelle (d.h. innerhalb eines Individuums...) Verträglichkeitsunterschiede. Das bedeutet, dass der Maier heute 1 Stunde bei 3 bar Sauerstoffpartialdruck ganz locker wegstecken kann, der Huber aber nach 45 Minuten vielleicht schon hops geht. Das bedeutet aber auch, dass es keineswegs sicher ist, ob nicht der Maier vielleicht morgen schon nach einer dreiviertel Stunde unter 3 bar Sauerstoff zu Schaden kommt!
Akzeptable Sauerstoffpartialdrucke für uns Sporttaucher sind 0,16 bis 1,6 bar.
Beim Presslufttauchen erreichen wir die 1,6 bar Sauerstoffpartialdruck erst bei 66 m. Da hat eh keiner was zu suchen und wird auch wegen des Tiefenrausches kaum was finden.
Bei einem sauerstoffangereicherten Atemgas, z.B. Nitrox 40, mit 40% Sauerstoffanteil und 60% Stickstoff, sind die 1,6 bar jedoch schon in 30 m Tiefe erreicht. Dahin zieht es doch die meisten von uns schon eher. Womit auch schon klar wird, dass sauerstoffangereicherte Atemgase nichts für Tieftaucher sind! Die Grenztiefe, englischer und damit moderner - MOD (Maximum Operating Depth) - lässt sich übrigens leicht berechnen:
MOD - Maximum Operating Depth
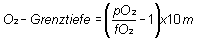
Im genannten Beispiel lautet die Rechnung 1,4/0,32 = 4,375; 4,375 - 1 = 3,375; 3,375 x 10 = 33,75 m
Sauerstoffpartialdrucke von über 0,5 bar führen bei längerer Exposition zu toxischer Schädigung des Alveolarepithels mit Hustenreiz, Schmerzen hinter dem Brustbein und Atemnot. Die Lungenschäden bezeichnet man auch als Lorrain-Smith-Effekt (L... wie Lunge).
Sauerstoffpartialdrucke von über 2 bar (manchmal auch schon geringere) wirken toxisch auf das zentrale Nervensystem: Paul-Bert-Effekt (mit B.. wie Beule am Kopf).
Eine ZNS-Vergiftung kann sich durch Kopfschmerzen, Lippenzittern, innere Unruhe, Ohrgeräusche, Augenflimmern und Schwindel ankündigen, sie kann aber auch ganz schlagartig als schwerer Krampfanfall in Erscheinung treten. Ein solcher endet unter Wasser praktisch immer im Chaos....
Bei körperlicher Belastung erhöht sich das Risiko einer Sauerstoffvergiftung ganz erheblich!
Beim Tauchen mit sauerstoffangereicherten Atemgasen müssen somit Tiefenlimits und bestimmte Zeitlimits eingehalten werden. Letztere sind in Erfahrungstabellen zusammengefasst. So beträgt das O2-Zeitlimit für das ZNS bei 1,6 bar Sauerstoffpartialdruck 45 min und das 24 h-Maximum 150 min.
Das Zeitlimit für die Lungen lässt sich anhand sogenannter OTUs berechnen (Oxygen Toxicity Units). Auch hierfür gibt es Tabellen, die insbesondere bei den Berufstauchern Verwendung finden, aber auch für den Nitrox-Vieltaucher wichtig werden können. Wie man an solche Tabellen kommt, könnt Ihr von den Nitrox-Verbänden (einfach mal in einer Suchmaschine "Nitrox" eingeben) oder bei mit Nitrox ausbildenden Tauchschulen oder natürlich bei mir erfahren.

